Formation Qualité Dispositifs Médicaux et ISO 13485
Pourquoi un système de management de la qualité pour les fabricants, distributeurs et importateurs de dispositifs médicaux ?
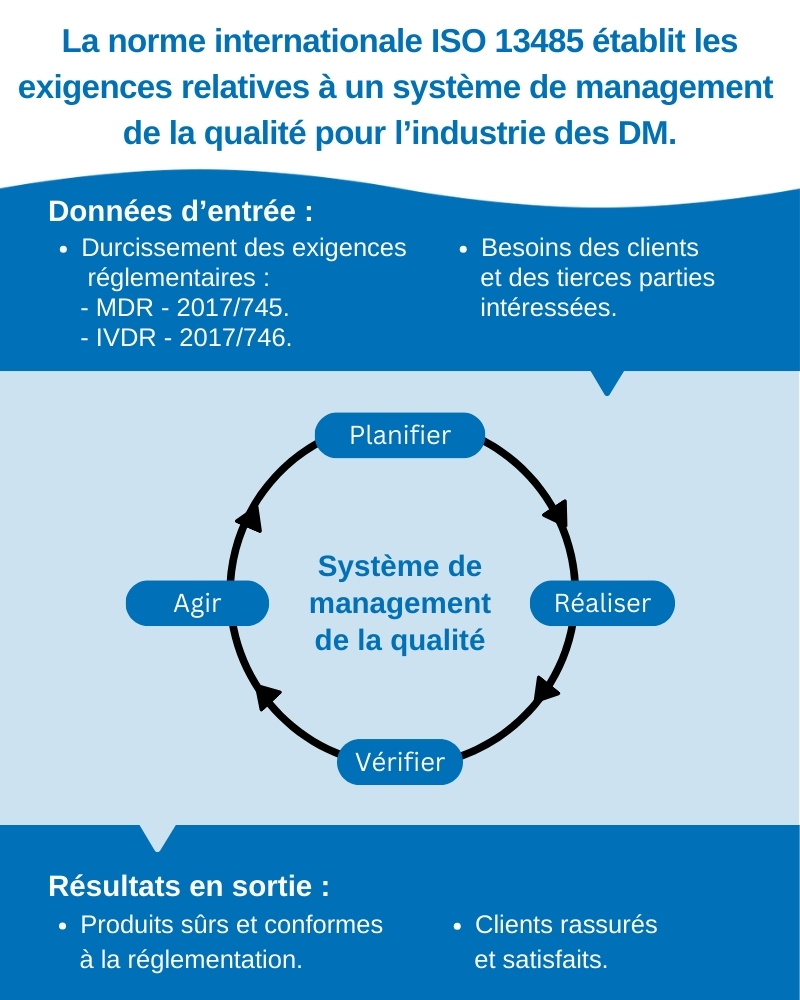
Le règlement (UE) 2017/745 identifie des exigences en matière de management de la qualité. Pour se conformer au Règlement Européen, il est donc nécessaire de mettre en place un système de management de la qualité relatif aux dispositifs médicaux.
La norme ISO 13485 : clé de voûte du système de management de la qualité des Dispositifs Médicaux
La norme ISO 13485 :2016 propose un cadre pour les Système de Management de la Qualité dans le domaine des Dispositifs Médicaux. Elle permet de garantir la conformité au Règlement Européen en matière de SMQ et sert largement de référence pour sa construction et son maintien même si la certification ISO 13485 n’est pas obligatoire.
Le Management de la qualité des DM : une garantie de fiabilité et de performance
Avec la mise en place d’un SMQ, l’entreprise maîtrise :
- les processus de conception, de développement et de fabrication,
- ses fournisseurs,
- les exigences de ses clients. Un SMQ assure la qualité et les performances du dispositif médical tout au long de son cycle de vie.
La validation des processus, la gestion des risques, la traçabilité des produits, les modifications de produit, la communication aux autorités compétentes sont autant de sujets qui sont gérés au travers du système de management de la qualité.
Le système de management de la qualité est donc le socle indispensable à la gestion de la conformité réglementaire, au maintien d'une relation de confiance avec les différentes parties intéressées et au pilotage d'une démarche d'amélioration continue.

Pourquoi est-ce important pour l'encadrement et les collaborateurs de suivre une formation qualité dispositifs Médicaux?
De nombreux collaborateurs sont impliqués dans la mise en œuvre, le pilotage et le maintien d’un SMQ. Ce projet est structurant pour une entreprise : Il permet de fédérer les équipes autour d’objectifs communs mais il requiert aussi de nombreuses compétences.
Etape 1 : Unir les équipes avec une formation ISO 13485
Avec une formation ISO 13485, vous posez les bases d’une compréhension commune des exigences et des objectifs du système de management de la qualité, cette formation s’appuie communément sur le cadre offert par la norme ISO 13485 :2016.
Développer les compétences avec une formation qualité dispositifs médicaux spécifique
En fonction du rôle et de l’expertise de chacun, des besoins générés par l’activité et le produit lui-même, des formations plus spécifiques sont également proposées comme par exemple :
Les avantages de l’offre de formation qualité dispositifs médicaux


Avec son statut d’organisme notifié en Allemagne et ses laboratoires accrédités à l’international, le groupe TÜV Rheinland dispose d’une solide expertise en interne pour maîtriser les exigences réglementaires et normatives relatives aux dispositifs médicaux.
Les formations DM qualité chez TÜV Rheinland sont optimisées en termes de durée pour :
- Cibler le bagage théorique clé,
- Mettre l’accent sur la mise en pratique, les mises en situation et les études de cas,
- Bénéficier du retour d’expérience des formateurs qualité DM.
Nos formateurs ont tous une expérience solide dans le domaine de la qualité, en matière de conseil ou d’audit et de management de la qualité chez des fabricants de dispositifs médicaux.
Questions fréquemment posées
À qui nos modules de formation qualité dispositifs médicaux s’adressent-ils spécifiquement ?
La grande majorité de nos modules de formation de qualité dispositifs médicaux s’adresse aux départements Qualité et Affaires Réglementaires mais elle permet également de sensibiliser la Direction, les départements Achats, R&D, Marketing & Ventes, Production, etc.
Quels thèmes clés sont couverts par notre gamme de formations qualité dispositifs médicaux ?
Notre gamme de formation qualité dispositifs médicaux couvre le cadre à respecter pour mettre en place et piloter un système de management de la qualité. Elle couvre ainsi les exigences de la norme ISO 13485:2016, l’audit interne selon la norme ISO 13485, la gestion des modifications change control, ou la validation des procédés de fabrication des DM. Elle traite également le cas spécifique de la validation des logiciels dispositifs médicaux. Dans la catégorie Développement et Evaluation des DM,vous trouverez d’autres formations en lien avec le management de la qualité, notamment la gestion des risques selon la norme ISO 14971.
Comment ces formations aident-elles à anticiper les non-conformités et à maintenir une démarche d’amélioration continue ?
La norme ISO 13485 vise, entre autres, à garantir la conformité en identifiant et maîtrisant les exigences applicables et prévoit également de gérer les non-conformités. La formation ISO 13485 fournit notamment un cadre pour la maîtrise des produits non-conformes, le traitement des réclamations ou bien le signalement aux autorités compétentes. Le cadre proposé par la norme ISO 13485 constitue une base solide pour l’amélioration continue.
Comment une formation ISO 13485 contribue-t-elle à la conformité réglementaire des dispositifs médicaux ?
Les exigences réglementaires et normatives applicables aux dispositifs médicaux sont multiples et requièrent une approche très structurée pour les maîtriser tout au long de la vie du produit, cette approche est décortiquée dans la formation à la norme ISO 13485 :2016. On rappelle ici que le Règlement (UE) 2017/745 impose la mise en place d’un système de management de la qualité et que la norme ISO 13485 est une référence en matière de management de la qualité pour les dispositifs médicaux. Si vous souhaitez approfondir vos connaissances sur la règlementation européenne, vous pouvez consultez notre offre de formation affaires règlementaires de dispositifs médicaux
Quels points clés sont abordés dans la formation sur l’audit interne selon la norme ISO 13485:2016 ?
La formation permet de traiter les exigences de la norme ISO 13485 dans la perspective de l’audit interne, c’est-à-dire la recherche de preuves de la conformité du SMQ.
Lors de cette formation, on travaille :
- la préparation et l’ouverture de l’audit,
- les modalités de communication avec l’audité mais aussi au sein de l'équipe d'audit,
- la rédaction d’un rapport d’audit et des fiches de non-conformité,
- la réunion de clôture.Les mises en situation permettent de s’entraîner dans les conditions les plus proches possibles de la réalité de l’audit interne. La formation prépare également les futurs auditeurs internes au suivi des actions post-audit.
Comment la formation sur le "Change Control" contribue-t-elle à maîtriser les modifications des dispositifs médicaux ?
La formation rappelle le contexte réglementaire pour la maîtrise des modifications, identifie les guides existants et définit les différents types de modification. On distingue les étapes du « change control » et on met en évidence le lien avec la gestion des risques. La formation traite de la planification des actions à engager, notamment auprès des autorités compétentes, de la documentation des modifications mais aussi de la planification des modifications elles-mêmes et des communications associées.
Quels sont les sujets couverts par la formation sur la validation des procédés de fabrication des dispositifs médicaux ?
La formation détaille les étapes de la démarche d'une validation de procédé (identification des variables du procédé, identification des caractéristiques du produit, analyse de risque du procédé, QI/QO/QP) et les ressources associées, elle rappelle les outils mathématiques et statistiques appropriés et identifie les éléments à prendre en compte pour le maintien et la surveillance du procédé et la gestion des modifications. Afin de permettre une meilleure appropriation des notions, différents procédés de fabrication de dispositifs médicaux sont traités en pratique.
En quoi consiste la validation des logiciels dans le contexte de la norme 13485:2016 ?
La validation des logiciels est abordée dans 3 sections de cette norme :
- Logiciels pour la maîtrise documentaire du système qualité (§4.1.6)
- Logiciels utilisés en production (§7.5.6)
- Logiciels utilisés pour les activités métrologiques (§7.6)
La norme reprend succinctement l'état de l'art actuel de la pratique de validation. Le terme "validation" revêtant une importance particulière, puisqu'il s'agit en pratique d'apporter une conclusion administrative quant à la maîtrise des risques liés à l'usage de ce logiciel pour assurer la conformité à la norme ISO 13485.
Pour prononcer cette validation, des preuves doivent être collectées, ce qui peut nécessiter la réalisation de tests de qualification.
La démarche à engager pouvant dépendre de la nature du logiciel et des risques associés à sa mise en œuvre, les méthodologies d'évaluation des risques, la nature des essais requis, les modalités de revalidation et de gestion des modifications sont notamment à définir dans des procédures du système qualité.Quels sont les principaux défis liés à la validation des logiciels dans un environnement médical ?
Lister tous les logiciels utilisés,
Identifier comment leur utilisation est encadrée,
Différencier les approches selon le logiciel,
Privilégier une approche modulaire pour des logiciels complexes,
Evaluer les niveaux de risques associés à l'utilisation des logiciels listés pour :
- Prioriser les validations,
- Identifier la nature des preuves à apporter y compris la nécessité de procéder à des tests de qualification,
Produire la documentation de preuve,
Déployer le logiciel, notamment auprès de nouveaux collaborateurs,
Maîtriser l'environnement d'implantation du logiciel et les accès utilisateurs,
Sécuriser les signatures électroniques,
Revalider périodiquement le droit de continuer à utiliser ces logiciels,
Gérer les modifications apportées aux logiciels validés,
…
Nos Modules de formation Dispositifs Médicaux Qualité
-
Cette formation s’adresse à toute personne amenée à réaliser des audits internes selon la norme ISO 13485.
-
S'approprier les exigences de la norme ISO 13485:2016
La structure, les exigences de la norme ISO 13485:2016. -
La maîtrise des modifications sur un DM ("Change control")
Mettre en place un processus de "change control" conforme à la réglementation européenne et internationale -
Auditeur interne Qualité dans le domaine Médical selon la norme ISO 13485:2016
Les rôles et responsabilités des membres de l’équipe d’audit, la conduite de l'audit, le rapport et le suivi. -
Validation des logiciels dans le contexte donné par la norme ISO 13485:2016
Les exigences de la norme ISO 13485:2016 sur la validation des logiciels et la mise en oeuvre des processus de validation. -
Nouveau format
Validation des procédés de fabrication des DM
Un approfondissement pas-à-pas de la démarche de validation des procédés des dispositifs médicaux.
